学院新闻
2025年2月12日我院贾奥琳教授联合西湖大学柴继杰教授及德国马普研究所Jane E. Parker 教授,以共同第一作者在世界顶级期刊《自然》发表了表题为“Balanced plant helper NLR activation by a modified host protein complex”的最新研究论文。该成果提出了TNL类抗病蛋白产生的免疫信号分子,ADPr-ATP,作为“危险信号”使EDS1-SAG101复合物构象发生变化,进而来激活下游辅助蛋白NRG1A的免疫应答机制;首次解释了植物NLR被非效应蛋白激活的分子机制;也揭示了NRG1C蛋白通过竞争结合了“危险信号”的EDS1-SAG101来负调控辅助蛋白NRG1A介导的免疫反应的负调控机制。
 TNL类抗病蛋白,在感知到病原微生物之后形成四聚化的“抗病小体”。这些抗病小体就像古时候负责点燃烽火台的卫兵,一系列免疫信号分子由此产生,包括ADPr-ATP和di-ADPR在内,作为植物中一类重要的信号分子,能够“召唤”出EDS1-SAG101蛋白质,与之结合形成复合物。这个复合体,会进一步“召集”免疫“助手”,即辅助蛋白NRG1,由此形成ADPr-ATP/di-ADPR、EDS1-SAG101和NRG1的新单元,最终形成具有钙离子通道活性的“抗病小体”,实现植物被病菌侵染部位的组织坏死(又称“超敏反应”)
TNL类抗病蛋白,在感知到病原微生物之后形成四聚化的“抗病小体”。这些抗病小体就像古时候负责点燃烽火台的卫兵,一系列免疫信号分子由此产生,包括ADPr-ATP和di-ADPR在内,作为植物中一类重要的信号分子,能够“召唤”出EDS1-SAG101蛋白质,与之结合形成复合物。这个复合体,会进一步“召集”免疫“助手”,即辅助蛋白NRG1,由此形成ADPr-ATP/di-ADPR、EDS1-SAG101和NRG1的新单元,最终形成具有钙离子通道活性的“抗病小体”,实现植物被病菌侵染部位的组织坏死(又称“超敏反应”)
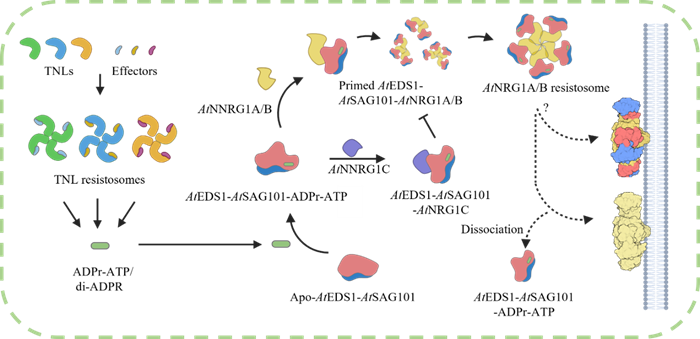 如何保证不会过度免疫,不对植物造成过度伤害、导致植株矮小甚至死亡?研究发现,辅助蛋白NRG1有三个同源蛋白NRG1A、NRG1B、NRG1C三种,其中EDS1-SAG101-NRG1A/B复合物,会形成NRG1A/B抗病小体,作为钙离子通道,激活下游的免疫反应。剩下的NRG1C呢?这一次最有意思的发现,正与它有关。植物遗传学及生物化学实验揭示,NRG1C蛋白负责下调免疫“强度”,也就是抑制过度免疫。它的结构与NRG1A和NRG1B不同(其有一个不完整的NOD结构域),因而无法进一步拼成“抗病小体”。但是,妙就妙在,NRG1C拥有更高的亲和力,可以与NRG1A/B竞争。想象一下,眼前有100个已被激活的EDS1-SGA101,当NRG1C一马当先地与其中90个发生结合,留给NRG1A和NRG1B的也只剩10个。由此,植物不会因为持续地免疫而使自身矮小,也就达成了免疫调控,植物得以维持免疫与生长的平衡。
如何保证不会过度免疫,不对植物造成过度伤害、导致植株矮小甚至死亡?研究发现,辅助蛋白NRG1有三个同源蛋白NRG1A、NRG1B、NRG1C三种,其中EDS1-SAG101-NRG1A/B复合物,会形成NRG1A/B抗病小体,作为钙离子通道,激活下游的免疫反应。剩下的NRG1C呢?这一次最有意思的发现,正与它有关。植物遗传学及生物化学实验揭示,NRG1C蛋白负责下调免疫“强度”,也就是抑制过度免疫。它的结构与NRG1A和NRG1B不同(其有一个不完整的NOD结构域),因而无法进一步拼成“抗病小体”。但是,妙就妙在,NRG1C拥有更高的亲和力,可以与NRG1A/B竞争。想象一下,眼前有100个已被激活的EDS1-SGA101,当NRG1C一马当先地与其中90个发生结合,留给NRG1A和NRG1B的也只剩10个。由此,植物不会因为持续地免疫而使自身矮小,也就达成了免疫调控,植物得以维持免疫与生长的平衡。
 在2022年,贾奥琳以第一作者在《科学》杂志上发表的“Identification and receptor mechanism of TIR-catalyzed small molecules in plant immunity”和“TIR-catalyzed ADP-ribosylation reactions produce signaling molecules for plant immunity”两篇论文,正是发现了植物中广泛存在的新型植物免疫信号分子,可以作为通用的天然免疫分子来抵御多种植物病害。该研究为育种家培育更高抗病能力的作物和科学家设计更具保护能力的小分子提供了理论支持。
在2022年,贾奥琳以第一作者在《科学》杂志上发表的“Identification and receptor mechanism of TIR-catalyzed small molecules in plant immunity”和“TIR-catalyzed ADP-ribosylation reactions produce signaling molecules for plant immunity”两篇论文,正是发现了植物中广泛存在的新型植物免疫信号分子,可以作为通用的天然免疫分子来抵御多种植物病害。该研究为育种家培育更高抗病能力的作物和科学家设计更具保护能力的小分子提供了理论支持。
 西湖大学生命科学学院讲席教授柴继杰及德国马普研究所Jane E. Parker 教授为论文共同通讯作者。西湖大学生命科学学院博士后黄诗嘉、德国马普研究所博士后王俊丽、清华大学2022级博士生宋日丹和河南农业大学贾奥琳教授为论文共同第一作者。中科院植物所肖裕研究员、西湖大学访问学者孙玥博士、西湖大学2024级博士生王琳、西湖大学韩志富研究员、德国马普研究所博士生Dennis Mahr、不列颠哥伦比亚大学吴忠寿博士和李昕教授等也为该研究做出了重要贡献。北京大学现代农业研究院冷冻电镜平台的赵珺博士对冷冻电镜数据收集给予了大力指导和帮助,上海同步辐射光源为本研究提供了设备和技术支持。
西湖大学生命科学学院讲席教授柴继杰及德国马普研究所Jane E. Parker 教授为论文共同通讯作者。西湖大学生命科学学院博士后黄诗嘉、德国马普研究所博士后王俊丽、清华大学2022级博士生宋日丹和河南农业大学贾奥琳教授为论文共同第一作者。中科院植物所肖裕研究员、西湖大学访问学者孙玥博士、西湖大学2024级博士生王琳、西湖大学韩志富研究员、德国马普研究所博士生Dennis Mahr、不列颠哥伦比亚大学吴忠寿博士和李昕教授等也为该研究做出了重要贡献。北京大学现代农业研究院冷冻电镜平台的赵珺博士对冷冻电镜数据收集给予了大力指导和帮助,上海同步辐射光源为本研究提供了设备和技术支持。







